STANDARYZACJA SYSTEMU WYMIANY DANYCH
We współczesnej diagnostyce laboratoryjnej elektroniczny przepływ informacji jest powszechny i stanowi efekt upowszechnienia laboratoryjnych systemów informatycznych (LIS). Przepływ danych następuje wielokierunkowo – między laboratorium, a odbiorcą wyniku (pacjentem, lekarzem), podmiotem prowadzącym kontrolę jakości badań, a także firmą serwisującą aparaturę i oprogramowanie typu middleware [1]. W celu zapewnienia sprawnego przepływu kompletu informacji niezbędne jest bezpośrednie połączenie medycznych laboratoriów diagnostycznych (MLD) z krajowym systemem informatycznym ochrony zdrowia (elektroniczna dokumentacja medyczna) oraz wykorzystanie takich narzędzi, jak e-skierowanie czy też Internetowe Konto Pacjenta (IKP).
Jak wynika z doświadczenia, warunkiem efektywnego obiegu danych i informacji w diagnostyce laboratoryjnej jest ich standaryzacja, zapewniająca jednorodny charakter gromadzonych i przesyłanych zbiorów danych na każdym etapie postępowania. Na podstawie projektu badawczego finansowanego ze środków Narodowego Programu Zdrowia – wykorzystującego wielkie zbiory danych gromadzonych w procesie świadczenia usług diagnostyki laboratoryjnej [2], udostępnione przez jeden z największych podmiotów świadczących tego rodzaju usługi w Polsce – w ramach którego zbadano 1,17 mld wyników badań laboratoryjnych (rekordów) zarejestrowanych w okresie od 2014 r. do połowy 2019 r. (w tym 778 mln rekordów z lecznictwa ambulatoryjnego oraz 395 mln rekordów z lecznictwa szpitalnego), obok wniosków dotyczących częstości wykonywania poszczególnych badań, występowania wyników nieprawidłowych, a także skali odchyleń od wartości referencyjnych, sformułowano wnioski dotyczące samych danych.
Badanie wykazało, że standaryzacja zapisu danych oraz uzyskanie ich jednorodności w badaniach laboratoryjnych nie są łatwe nawet w wypadku pojedynczego podmiotu. Ten, który udostępnił dane do badań, posiada stale rozwijającą się sieć placówek, do której dołączane są nowe, razem z własnymi procedurami i systemami informatycznymi (to powoduje, że na przestrzeni czasu ujawniają się różnice w zakresie nazewnictwa, przedziałów wartości referencyjnych oraz jednostek wyrażania wyniku). Nie stanowi to istotnego problemu, jeżeli lekarz zlecający, współpracujący z danym laboratorium, zna jego rutynę, w tym metody badań, wartości referencyjne i decyzyjne wyników, a w razie wątpliwości kontaktuje się bezpośrednio z personelem laboratorium i odwrotnie: jeżeli diagnosta laboratoryjny w razie wątpliwości, np. co do sposobu i celu pobrania materiału lub panelu zleconych badań, może zwrócić się z pytaniem do lekarza zlecającego.
Jeżeli natomiast wyniki trafiają do lekarza nieznającego specyfiki laboratorium, powstałe wątpliwości mogą prowadzić do podejmowania niewłaściwych decyzji klinicznych. Wówczas reakcją lekarza zlecającego jest najczęściej powtórzenie badania, co nie rozwiązuje problemu, jeżeli chodzi o wynik starszego badania. Już sam fakt pojawienia się na rynku middleware – czyli oprogramowania służącego wyłącznie do skomunikowania ze sobą systemów opartych na różnych formatach danych, pokazuje jak bardzo istotne jest umożliwienie prostej, szybkiej i niemającej wpływu na jakość danych wymiany informacji. Przy czym opieranie się na middleware jako na rozwiązaniu problemu nie jest wyjściem optymalnym, w szczególności w kontekście ochrony zdrowia, gdzie priorytetem powinno być zabezpieczenie możliwie szybkiego działania w interesie pacjenta, czemu bezpośrednio przeciwstawia się mnożenie czynników mających wpływ na funkcjonowanie laboratoriów diagnostycznych. Stosując middleware laboratoria (i inne podmioty korzystające) uzależniają utrzymanie odpowiedniego poziomu interoperacyjności od działania osoby trzeciej (dostawcy middleware), którego pozycja kontraktowa, podobnie jak w przypadku LIS, budowana na zależności, może z czasem negatywnie wpływać na działalność laboratorium.
Postępująca informatyzacja danych medycznych, a zwłaszcza diagnostyki laboratoryjnej, sprawia, że większość dokumentacji medycznej jest prowadzona za pomocą systemów informatycznych. Akty prawne takie jak unijne rozporządzenie EHDS (europejska przestrzeń danych dotyczących zdrowia) wymagające cyfryzacji wyników badań i danych pacjenta, w celu zwiększenia ich dostępności, stanowią kolejny czynnik przemawiający za nadaniem szczególnej wagi procesowi ujednolicania przepływu danych.
Dążąc do wyeliminowania niekorzystnego wpływu, jaki na proces diagnostyki i leczenia ma brak standaryzacji danych z badań diagnostycznych eksperci Polskiego Towarzystwa Diagnostyki Laboratoryjnej przedstawiają projekt Systemu Standaryzacji Informacji w Diagnostyce Laboratoryjnej (SSIDL) – systemu zapewniającego z jednej strony standaryzację danych generowanych w ramach procesów diagnostyki laboratoryjnej, a z drugiej strony ich wysoką jakość.
Projektowane wdrożenie systemu podzielono na etapy, w ramach których uruchamiane byłyby kolejne funkcjonalności oparte na podstawowym elemencie w postaci standaryzacji obiegu danych, w szczególności w zakresie nazewnictwa. Projekt jest propozycją wstępną – w przypadku wyrażenia zainteresowania jego wdrożeniem wymagał będzie rozszerzenia o elementy integracji z rozwiązaniami powstającymi w ramach Centrum e-Zdrowia.
Od 1998 r. w kraju stosuje się nazewnictwo Klasyfikacji Badań Laboratoryjnych [3], włączone później do wspólnego zbioru nazewnictwa procedur medycznych (ICD-9 CM) [4].
Tempo rozwoju medycyny laboratoryjnej i rozszerzający się zakres badań realizowanych w polskich laboratoriach (i wykładniczy wzrost tych parametrów) wykluczają możliwość posługiwania się wyłącznie metodyką opracowaną na podstawie założeń nieprzewidujących tak szybkiego postępu technologicznego. Dlatego medyczne laboratoria diagnostyczne wprowadzają własne nazewnictwo oraz kody wykonywanych badań, które wykluczają analizę porównawczą w skali kraju. Problem ten tworzy ogromną barierę, nie tylko w relacjach pomiędzy samymi laboratoriami, ale przede wszystkim w relacji laboratorium – państwowy system ochrony zdrowia m.in. utrudniając znacznie prace nad e-skierowaniem na badania laboratoryjne.
UJEDNOLICENIE WYMIANY DANYCH – SSIDL I LOINC®
Odpowiedzi na powyższe problemy eksperci Polskiego Towarzystwa Diagnostyki Laboratoryjnej upatrują we wdrożeniu narzędzia, precyzyjnie i jednoznacznie określającego badania laboratoryjne, również w skali międzynarodowej, adaptującego system Logical Observation Identifiers Names and Codes (LOINC®), opracowany i utrzymywany przez Regenstrief Institute Inc. [5] Wiosną 2021 r. między PTDL a Regenstrief Institute została a zawarta umowa na adaptację systemu LOINC w Polsce.
SSIDL umożliwiałby usystematyzowanie, poprawę jakości oraz pewności przetwarzania danych i informacji dotyczących diagnostycznych badań laboratoryjnych i składałby się z następujących elementów:
- rozpoznawalne na poziomie międzynarodowym, ujednolicone nazewnictwo badań,
- system informatyczny zintegrowany z budowanym systemem e-skierowania (P1),
- katalog procedur inicjowanych w procesie zlecania badań i wysyłania raportów z wykonania badań przez laboratoria.
Docelowo Systemem Standaryzacji Informacji w Diagnostyce Laboratoryjnej powinien umożliwiać uzyskanie:
a) jednoznaczności nazw i kodów procedur z zakresu diagnostyki laboratoryjnej, w skali krajowej oraz międzynarodowej;
W tym celu konieczne jest wprowadzenie systemu nazewnictwa badań laboratoryjnych, który byłby kompletny oraz na bieżąco rozwijany i uzupełniany w miarę dynamicznego rozwoju metod i obszarów diagnostyki. Optymalnym rozwiązaniem jest, aby wprowadzany system miał zasięg międzynarodowy, tak aby stosując polskie nazwy i uniwersalne kody można było łatwo i w pełni wiarygodnie dokonywać tłumaczenia dokumentacji medycznej w zakresie diagnostyki laboratoryjnej.
b) pewności co do kluczowych cech procedur, w tym analitu, materiału, metody, sposobu wyrażania wyników;
Ujednolicenie nazewnictwa należy rozciągnąć z nazwy analitu na nazwy metod, materia u, jednostek (sposobu) wyrażania wyniku oraz określenie krytycznych parametrów, które decydują o interpretacji wyniku, tak na poziomie laboratorium, jak i osoby zlecającej (np. pobranie materiału na czczo lub nie na czczo czy pora pobrania materiału).
c) pewności co do przedziału wartości referencyjnych, wartości decyzyjnych oraz ich aktualizacji w zależności od czynników technologicznych czy indywidualnych cech pacjenta;
Interpretacja wyników, w szczególności liczbowych, opiera się na wartościach referencyjnych/decyzyjnych, przy czym są one często podawane w literaturze (w tym w zaleceniach praktyki klinicznej), ale także przez producentów sprzętu laboratoryjnego i odczynników w zależności od metod, czy w końcu przez same laboratoria. Ponieważ wartości te mogą się znacznie różnić, a dla interpretacji są kluczowe, należy doprowadzić do umożliwienia prezentacji ich bieżącej i aktualnej wartości w odniesieniu do danego badania w danym laboratorium.
d) dostępu do informacji niezbędnych do interpretacji wyniku;
Wraz ze skierowaniem oraz w raporcie z badań laboratoryjnych wracającym do zlecającego powinny być dostępne minimalne informacje kliniczne pozwalające na właściwą interpretację wyniku. Informacja taka powinna być dostępna przede wszystkim w sytuacjach, gdy interpretacja wyniku zależy od danego czynnika. Dodatkowo, odniesienie wyniku danego badania do wyników podobnych badań w dużej populacji pacjentów pozwoli oby na odpowiednią ocenę kliniczną stanu chorego.
3) jasności co do objęcia procedur laboratoryjnych regulacjami koszyka świadczeń gwarantowanych.
Ponieważ dziedzina diagnostyki laboratoryjnej ulega bardzo szybkim zmianom technologicznym, zasadne jest bieżące reagowanie na ten rozwój poprzez świadome i aktywne decyzje co do objęcia finansowaniem badań laboratoryjnych ze środków publicznych, czyli włączeniem do koszyka świadczeń gwarantowanych. Dodatkowo, regulacje „koszyka świadczeń” wydane na podstawie art. 31d ustawy z dnia 27 sierpnia 2004 r. o świadczeniach opieki zdrowotnej finansowanych ze środków publicznych, czasem wskazują świadczenia, w ramach których powinny być realizowane poszczególne badania laboratoryjne. Informacja o tych włączeniach lub wyłączeniach z finansowania również powinna być udostępniana w systemie
Schemat współpracy systemu SSIDL z P1
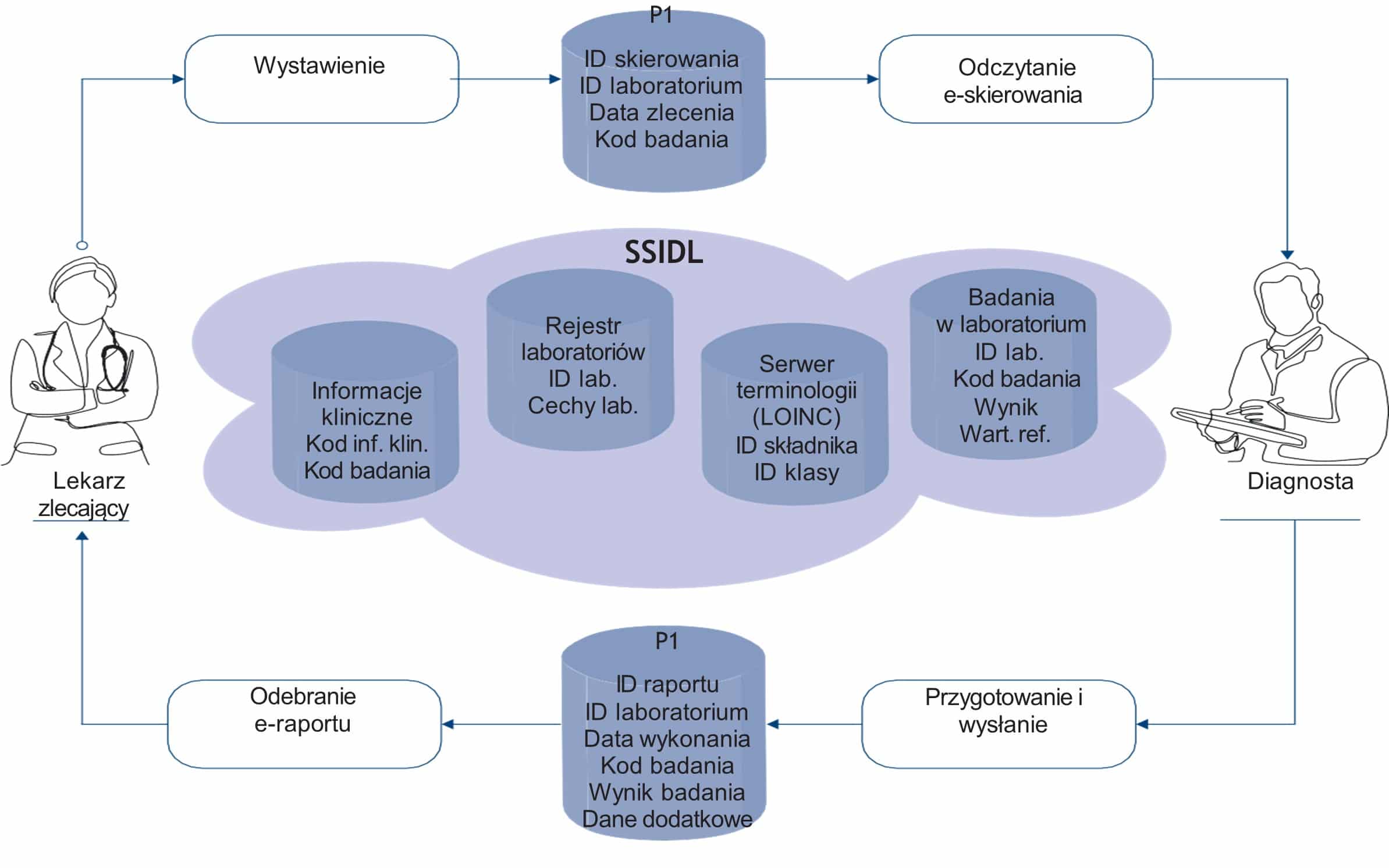
BENEFICJENCI WDROŻENIA SSIDL
System informatyczny realizujący funkcjonalności SSIDL powinien być zintegrowany funkcjonalnie z systemem P1, obsługującym w szczególności e-skierowanie. Tego rodzaju integracja umożliwi wykorzystanie zasobów SSIDL zarówno przez zlecających badanie oraz instytucje i osoby realizujące badanie.
Po ujednoliceniu nazewnictwa i kodowania badań oraz umożliwieniu porównywalności wartości referencyjnych/ decyzyjnych wyniki badań mogłyby być udostępniane na poziomie Internetowego Konta Pacjenta zarówno samym pacjentom, jak i upoważnionemu personelowi medycznemu. Zatem populacja, do której adresowany jest projekt, jest tożsama z populacją użytkowników systemu P1 oraz powiązanych produktów. Należy podkreślić, że aktualnie e-skierowanie nie obejmuje badań laboratoryjnych, ale są plany, żeby uwzględnić tę funkcjonalność. W obecnych założeniach IKP prezentuje tylko informację o badaniu jako zdarzeniu medycznym i wskazuje lokalizację, gdzie wyniki można uzyskać.
AKTUALNE STANDARDY
Zgodnie z informacją Krajowej Izby Diagnostów Laboratoryjnych w kraju działają 2734 medyczne laboratoria diagnostyczne. Szacuje się, że w 2020 r. wydatki na badania laboratoryjne wyniosły ok. dwóch miliardów złotych [6]. Działalność medycznych laboratoriów diagnostycznych, w zakresie zasad i warunków wykonywania czynności diagnostyki laboratoryjnej, określa ustawa z dnia 10 grudnia 2022 roku o medycynie laboratoryjnej (Dz.U.2023.2125 t.j. z dnia 2023.10.04). Szczegółowo natomiast regulowana jest zapisami Rozporządzenia Ministra Zdrowia w sprawie standardów jakości dla medycznych laboratoriów diagnostycznych i mikrobiologicznych (Dz.U.2019.1923 t.j. z dnia 2019.10.10) [7]. Rozporządzenie to określa standardy jakości w zakresie czynności wykonywanych w ramach laboratoryjnej diagnostyki medycznej, a także oceny ich jakości i wartości diagnostycznej oraz laboratoryjnej interpretacji i autoryzacji wyników badań. Co prawda rozporządzenie utraciło moc po upływie 12 miesięcy od dnia wejścia w życie ustawy o medycynie laboratoryjnej, jednakże w związku z brakiem zastępującego je aktu wykonawczego, w dalszym ciągu stosuje się opisane w nim standardy.
Zlecenia badań
Wymagania związane z przetwarzaniem informacji medycznej rozpoczynają się od określenia zakresu informacji, które powinny znaleźć się na zleceniu (skierowaniu) badań laboratoryjnych (załącznik nr 1 Rozporządzenia):
- dane pacjenta, wśród których znajduje się nr PESEL, oraz miejsce zamieszkania, oddział szpitalny;
- daty pobrania materia u i wykonania badania;
- dane jednostki zlecającej.
W tym zakresie zasadne jest identyfikowanie typu jednostki zlecającej za pomocą kodów resortowych (cz. VIII kodu resortowego), co zostało określone w transformacie e-skierowania opracowanym przez Centrum e-Zdrowia [8]. Następne dane konieczne do określenia w skierowaniu dotyczą samego badania i są to:
- nazwa badania, rodzaj materiału i jego pochodzenie,
- tryb wykonania badania.
W wypadku niektórych rodzajów badań (np. genetycznych) ten zakres informacji jest dodatkowo rozszerzany (np. pełne rozpoznanie kliniczne/patomorfologiczne)” (art.SSIDL).
Wymagania podane w rozporządzeniu nie wskazują na formalizację zapisu rozumianą jako znormalizowane nazewnictwo badań, metod itp. danych, mimo że w transformacie e-skierowania występują odwołania do systemów sformalizowanego nazewnictwa i klasyfikacji zarówno krajowych (ICD-9_PL), jak i światowych (SNOMED-CT, LOINC). Innym ważnym elementem skierowania jest wskazanie kliniczne do wykonania badania oraz niezbędne dane kliniczne pacjenta, w tym rozpoznanie lub podejrzenie choroby. W odniesieniu do niektórych rodzajów badań (np. genetycznych), ten zakres informacji jest dodatkowo rozszerzany (np. o informacje o ewentualnej transplantacji lub transfuzji). Tutaj też nie obowiązuje wymóg formalizacji i jednolitości zapisu.
Procedura pracy laboratorium
Dalej w rozporządzeniu ujęto wymagania organizacyjne dotyczące procedur pracy laboratorium, związane z rejestracją i przetwarzaniem danych. Należy do nich m.in. informacja o procedurach pobierania materiału do badania. Tu również nie określono ani wymagań formalizacji, ani ujednolicania terminologii, ani klasyfikacji rodzaju materiału, czynników konserwujących i zapobiegających wykrzepianiu krwi lub innych czynności wpływających na stan materiału, mimo że czynniki te są istotne dla wykonawcy badania oraz w interpretacji wyników badań. Równie ważna jest informacja na temat metod diagnostycznych. Obowiązkiem laboratorium jest utworzenie listy wykonywanych badań oraz udostępnienie jej zleceniodawcom. W rozporządzeniu jest również mowa o tym, które badania można umieszczać na liście (opisane w publikacjach, rekomendowane i zgodne z zaleceniami właściwych instytucji, a także własne, zwalidowane).
Opis stosowanych metod badawczych
Ponadto laboratoria mają obowiązek walidować stosowane metody badawcze przed ich wdrożeniem, wskazując dla metod:
- komercyjnych (z wykorzystaniem odczynników dostępnych na rynku IVD) opracowanych i opisanych przez wytwórcę – ocenę precyzji i poprawności, która dokonywana jest dla co najmniej dziesięciu próbek;
- komercyjnych modyfikowanych w laboratorium – ocenę powtarzalności, odtwarzalności i poprawności, a także porównanie wiarygodności wyników badań uzyskiwanych podczas stosowania procedury zalecanej przez wytwórcę oraz procedury zmodyfikowanej przez laboratorium;
- opracowywanych w laboratorium – pełną walidację metody [4].
Spis procedur wykonywania badań i sprawozdania z badań
Zgodnie z normą PN-EN ISO 15189-2007 (Laboratoria medyczne – Szczególne wymagania dotyczące jakości i kompetencji), laboratoria są zobowiązane do sporządzania opisu procedur wykonywania badania, a następnie sprawozdania z wykonania badania. W sprawozdaniu z wykonania badania przekazane powinny być wymienione wcześniej informacje, takie jak:
- rodzaj badania i zastosowana metoda,
- rodzaj badanego materia u,
- wynik badania w formie liczbowej lub opisowej,
- przedział wartości referencyjnych,
- laboratoryjna interpretacja wyniku badania.
Powyższy zakres danych jest bardzo ważny zarówno na poziomie indywidualnym, w interpretacji klinicznej, jak i na poziomie populacji, w interpretacji statystycznej. Na obydwu poziomach formalizacja i standaryzacja przekazywanej informacji są warunkiem skutecznej komunikacji.
Jak już wspomniano, w wymienionym w rozporządzeniu zakresie danych nie wskazano wymogu formalizacji zapisów. W transformacie e-skierowania występują odwołania do systemów sformalizowanego nazewnictwa o charakterze międzynarodowym (SNOMED-CT, LOINC), ale przeszkodą jest tu brak polskich wersji językowych.
WDROŻENIE SSIDL
Złożoność SSIDL, zarówno z perspektywy obszaru pokrywanego przez system jak i poziomu skomplikowania poszczególnych elementów wyklucza jego jednorazową implementację.
I Etap – jednolita terminologia
Pierwszym etapem powinno być udostępnienie nowej, wszechstronnej terminologii wraz z systemem kodowania, która zastąpi zdezaktualizowaną Klasyfikację Badań Laboratoryjnych [3]. Optymalnym rozwiązaniem będzie wdrożenie nomenklatury LOINC, po jego przetłumaczeniu. Polska wersja terminologii LOINC® powinna zostać udostępniona w postaci tzw. serwera terminologii (terminology server), obsługującego tablice z nazwami badań laboratoryjnych. Pojęcie „serwer terminologii” nie stanowi precyzyjnie określonej funkcjonalności, lecz uznaje się, że jest to narzędzie umożliwiające zarządzanie zbiorem terminologii sformalizowanej, jego okresową aktualizację oraz mapowanie tego zbioru do innych zbiorów i klasyfikacji, udostępnianie pojęć synonimicznych oraz zewnętrznych odwołań [9]. Wskazane mapowanie jest szczególnie ważne wobec nazw badań laboratoryjnych występujących w regulacjach prawnych, jak i tych dotyczących koszyka świadczeń gwarantowanych [10].
System LOINC zapewnia zestaw uniwersalnych nazw i kodów (identyfikatorów) stosowanych w zapisie wyników badań laboratoryjnych (i innych obserwacji klinicznych, które pominięto w opisywanym przedsięwzięciu) [5]. Uniwersalne identyfikatory LOINC mogą być używane podczas wymiany informacji, dotyczących zlecenia (skierowania) i wyników (obserwacji) badań, między systemami informatycznymi funkcjonującymi w ochronie zdrowia. System LOINC jest wykorzystywany w systemach informatycznych stosujących różne standardy syntaktyczne [5]. Identyfikatory LOINC umożliwiają wymianę danych klinicznych między heterogenicznymi środowiskami informacyjnymi i informatycznymi. Mogą być wykorzystywane jako zakodowany zapis danych lub komunikatów zawierających obserwacje kliniczne. Mogą być przesyłane między systemem informatycznym laboratorium (LIS), a elektroniczną dokumentacją medyczną (electronic health record).
Twórcy LOINC kierowali się przede wszystkim pragmatyką rozwiązań. W rezultacie powstał system szeroko stosowany, ogólnoświatowy, choć metodologicznie bardziej heterogenny niż inne istniejące systemy sformalizowanej terminologii lub kodowania (coding systems). Celem starań twórców LOINC w zakresie badań laboratoryjnych jest stosowanie nazewnictwa o poziomie precyzji umożliwiającym zaprezentowanie każdego, osobno raportowanego, testu, badania, analitu. Jeżeli określony test ma w dokumentacji laboratoryjnej własną nazwę, wartość referencyjną, zasadniczo odmienną od innych testów, lub inne znaczenie kliniczne, to w systemie LOINC ma indywidualną nazwę. System zawiera jednocześnie nazwy poszczególnych zmiennych oraz ich zbiorów. Jeśli chodzi o zbiory, to LOINC definiuje panele obejmujące pewną pulę indywidualnych pomiarów oraz dokumenty stanowiące zbiór, niewyszczególnionych enumeratywnie, informacji.
Po wdrożeniu tego etapu możliwe będzie upowszechnianie stosowania standaryzowanej terminologii badań laboratoryjnych, obejmującej nie tylko nazwę analitu, ale także metody, sposoby wyrażania wyniku itp. Jak pokazuje doświadczenie z wdrożenia KBL, etap wdrożenia nowego systemu nazewnictwa badań może potrwać kilka lat i powinien być wsparty odpowiednimi zmianami regulacyjnymi.
Efektem wdrożenia tak określonego pierwszego etapu SSIDL będzie możliwość udostępniania, na bieżąco aktualizowanej, listy badań laboratoryjnych i ich kodów, co umożliwi utrzymywanie spójności nazewnictwa i kodowania badań laboratoryjnych w Polsce, a także w skali międzynarodowej, w kontekście unijnych planów wymiany dokumentacji medycznej.
II Etap – rejestr laboratoriów uczestniczących w SSIDL
Kolejnym wdrożonym elementem Systemu powinien być rejestr laboratoriów uczestniczących w SSIDL. Rejestr ten ma obejmować laboratoria stosujące standardy informacyjne, a przy tym ma umożliwiać prezentację pewnych dodatkowych informacji w odniesieniu do danego laboratorium, w stosunku do Rejestru Podmiotów Wykonujących Działalność Leczniczą [11]. Wśród informacji prezentowanych w powiązaniu z danymi rejestru laboratoriów znajduje się m.in. lista badań realizowanych przez dane laboratorium, uzupełniona o jednostki wyrażania wyników oraz wartości referencyjne/decyzyjne.
Poza tym, laboratorium będzie mogło przedstawić swoim partnerom zestawienie informacji klinicznych, które powinny towarzyszyć skierowaniu na dane badanie laboratoryjne, ewentualne uwagi dotyczące sposobu pobierania i przechowywania materiału i inne informacje służące komunikacji pomiędzy stronami w elektronicznym obrocie danych laboratoryjnych. Ponadto laboratoria będą mogły przedstawiać listę punktów pobrań i zasad ich pracy, a także certyfikaty kontroli zewnętrznej i informacje o charakterze marketingowym, czasie oczekiwania na wynik czy inne wybrane informacje istotne dla realizacji e-skierowania.
Ważną rolę w systemie SSIDL odgrywają wartości referencyjne w odniesieniu do danego badania. Wartości te są ustalane przez laboratorium, w zależności od stosowanych metod, jednostek pomiaru czy używanych odczynników. Mogą się zatem dość dynamicznie zmieniać, a jednocześnie są podstawą interpretacji wyniku. Stąd propozycja, by w SSIDL laboratoria umieszczały informacje o aktualnych przedziałach tych wartości, jeśli to konieczne, w odniesieniu do określonych serii wyników. Wartości referencyjne, identyfikowane z placówką i czasem ich obowiązywania, będą umożliwiać interpretację wyniku przez jego odbiorcę, także w odniesieniu do badań wykonywanych w przesz ości. Jednocześnie, wartości referencyjne podawane przez laboratoria mogą służyć jako narzędzie samokontroli laboratoriów, poprzez możliwość ich porównania między placówkami. Wśród wartości referencyjnych szczególną rolę odegrają tzw. wartości alarmowe (krytyczne), których przekroczenie wymaga szczególnie pilnej i skrupulatnej procedury docierania do odbiorcy. Na zaawansowanym etapie SSIDL będzie wyposażony również w instrukcje poprawnego postępowania w wypadku uzyskiwania określonych wyników.
III Etap – narzędzie wspomagania decyzji klinicznych
Ostatni etap wdrażania SSIDL ma obejmować funkcje wspomagania decyzji klinicznych (Clinical Decision Support), z wykorzystaniem danych gromadzonych w trakcie realizacji e-skierowań. System SSIDL będzie mógł wykonywać na bieżąco analizę rozkładu wyników poszczególnych badań w grupach pacjentów. Wyniki analizy będą udostępniane co najmniej kierownictwu poszczególnych laboratoriów, co umożliwi reakcję, jeśli rozkład ten będzie z niewyjaśnionych powodów odbiegał od wartości przeciętnych wielu placówek (benchmark). Również poszczególne wyniki indywidualnych pacjentów będą mogły być prezentowane na tle obserwowanych rozkładów wyników pacjentów o podobnych cechach; funkcja ta będzie pomocna w interpretacji wyniku badania przez lekarza. System będzie też umożliwiał analizę trendów i tendencji występowania określonych wyników w populacji, wspierające badania o charakterze epidemiologicznym, a także przeprowadzanie celowanych badań przesiewowych z wykorzystaniem badań laboratoryjnych (scoring). Obsługując standardowe komunikaty przekazywania wyników i zachowując odpowiednie zasady ochrony danych osobowych, system będzie mógł być również punktem wyjścia dla innych funkcjonalności, które będą mogły być tworzone z wykorzystaniem jego potencjału. Należy przy tym podkreślić, że wymienione funkcjonalności wymagają skoordynowania działań z Centrum e-Zdrowia i współpracy systemów SSIDL oraz P1” (art. SSIDL).
PODSUMOWANIE – EFEKTY WDROŻENIA SSIDL
Projekt Systemu Standaryzacji Informacji w Diagnostyce Laboratoryjnej wychodzi naprzeciw wyzwaniom dotyczącym spójności i wiarygodności elektronicznej informacji przesyłanej między laboratoriami, podmiotami wystawiającymi skierowania a pacjentami. Propozycja rozwoju SSIDL zakłada stopniowe wdrażanie poszczególnych funkcjonalności, w określonej kolejności wynikającej z wymagań technicznych oraz potrzeb użytkowników.
Pełna wersja SSIDL dostarcza wartość dodaną, wynikającą z masowego przetwarzania danych pochodzących z wprowadzenia e-skierowania na badania laboratoryjne oraz zwrotnego udostępniania wyników badań, w standaryzowanym formacie, w systemie elektronicznej dokumentacji medycznej na platformie P1 w IKP.
O korzyściach wynikających z połączenia elektronicznych skierowań oraz raportów z diagnostycznych badań laboratoryjnych w ramach jednolitego systemu wymiany danych będzie można mówić wówczas, jeżeli dane z laboratoriów będą przedstawiane w ustandaryzowany sposób. W takiej sytuacji SSIDL pełniłby funkcję punktu odniesienia w zakresie dynamicznych parametrów, takich jak zakres badań wykonywanych przez dane laboratorium lub zakres wartości referencyjnych danego badania z danego laboratorium w danym czasie. Jednocześnie system wspierałby procedury analityczne, wspomagające wnioskowanie kliniczne (clinical decision support) oraz zarządzanie jakością w diagnostyce laboratoryjnej.
Mierzalnymi efektami wdrożenia SSIDL byłyby:
- zmniejszenie redundancji badań, przekładające się bezpośrednio na mniejsze koszty diagnostyki;
- zmniejszenie obciążenia pracą personelu medycznego poprzez łatwy dostęp do odpowiednich danych laboratoryjnych;
- skrócenie procesu diagnostycznego dzięki eliminacji konieczności powtórnego wykonywania badań laboratoryjnych;
- zwiększenie precyzji diagnostyki, a co za tym idzie zwiększenie sukcesu terapeutycznego.
ŻRÓDŁA
- Solnica B (red.). Diagnostyka Warszawa: PZWL, 2021.
- Kozierkiewicz A, Wojtyniak B, et Ocena stanu zdrowia populacji na podstawie ogólnopolskiego zbioru wyników badań laboratoryjnych wraz z rekomendacjami. Warszawa: Narodowy Instytut Zdrowia Publicznego, Państwowy Zakład Higieny, 2020. https://www.pzh.gov.pl/wp-content/ uploads/2020/12/raport-Ocena-stanu-zdrowia-populacji-AK.pdf.
- Naskalski J (red.). Klasyfikacja Badań Kraków: Vesalius, 1998.
- Rector AL, Solomon WD, Nowlan WA, et A Terminology Server for Medical Language and Medical Information Systems. Meth Inform Med 34, 1995,
- 1-2, 147-57.
- Projekt rozporządzenia zmieniającego rozporządzenie w sprawie świadczeń gwarantowanych z zakresu leczenia [Online] 23 05 2019. [Zacytowano: 08 06 2019.] https://legislacja.rcl.gov.pl/projekt/12321793/katalog/12593111#12593111.
- MedTech European IVD Market Statistics Report: MedTech Europe, 2021. https://www.medtecheurope.org/wp-content/uploads/2022/01/ european-ivd-market-statistics-report-2021.pdf.
- Logical Observation Identifiers Names and Codes. The international standard for identifying health measurements, observations, and documents. [Online] Regenstrief Institute, Inc., 1994-2021. [Zacytowano: 20 09 2021.] https://loinc.org/.
- Rejestr Podmiotów Wykonujących Dzialaność Leczniczą. [Online] Centrum e-Zdrowia. [Zacytowano: 20 09 2021.] https://rpwdl.ezdrowie.gov. pl/. RPWDL v 2.30.10.
- Centrum e-Zdrowia. Centrum e-Zdrowia, Interoperacyjność . [Online] Centrum e-Zdrowia, 19 10 2019. [Zacytowano: 29 10 2020.] https://cez.gov.pl/ interoperacyjnosc/interfejsy/.
- Kozierkiewicz A (red). Międzynarodowa Klasyfikacji Procedur Medycznych, wraz z aneksem Klasyfikacja Badań Laboratoryjnych. Kraków: Wydawnictwo Medyczne „Vesalius”, 1999.
- Minister Zdrowia. Rozporządzenie Ministra Zdrowia z dnia 23 marca 2006 r. w sprawie standardów jakości dla medycznych laboratoriów diagnostycznych i mikrobiologicznych. U. 2006 nr 61 poz. 435, 2006.
- Kozierkiewicz A, Goralewska A, Jankowska-Kulawy A, Judycki T, Klimaszewska-Łata J, Kołtan S, Kopeć B, Koper-Lenkiewicz OM, Łangowski K, Osuch A, Rychlik U, Strug A, Surożyńska-Godzina I, Ura Ł, Wlazeł R, Wysocka E, Zieliński T, Solnica B. Standaryzacja informacji w diagnostyce laboratoryjnej. Propozycja Polskiego Towarzystwa Diagnostyki DIAGN LAB. 2022; 58: 21–30
- Kozierkiewicz A, Gilewski D, Goralewska A, Jankowska-Kulawy A, Klimaszewska-Łata J, Koper-Lenkiewicz OM, Ludziejewska A, Łangowski K, Małecka M, Młodzińska E, Rychlik U , Sapa-Wojciechowska A, Ura Ł, Wysocka E, Solnica Testowe tłumaczenie terminologii LOINC w zastosowaniu do diagnostyki laboratoryjnej w Polsce. DIAGN LAB. 2022; 58: 31–37.
