Nowy wpis
03 lutego 2025
Choroba Alzheimera (AD) to postać otępienia, którą charakteryzuje utrata pamięci, postępujący zanik zdolności intelektualnych, pogarszające się umiejętności rozumienia mowy i wysławiania się oraz zmiany charakterologiczne i behawioralne, które w końcu prowadzą do niemożności samodzielnego funkcjonowania.
Wprawdzie AD odzwierciedla pewne zmiany, które zachodzą w mózgu wraz z wiekiem, jednak nie jest częścią prawidłowego procesu starzenia. Powoduje uszkodzenie komórek nerwowych i prowadzi do ich śmierci.
Charakteryzuje ją nagromadzenie blaszek starczych (białko odkładające się w przestrzeni międzykomórkowej) i zmiany neurowłókienkowe (skręcone filamenty białkowe w komórkach nerwowych) w mózgu. W wyniku niszczenia komórek nerwowych obniża się również stężenie acetycholiny i innych neuroprzekaźników (substancji chemicznych niezbędnych do komunikacji pomiędzy komórkami nerwowymi) w mózgu. Z czasem AD prowadzi do obniżonej interakcji pomiędzy różnymi obszarami mózgu.
Związek ze starzeniem się
Szacuje się, że na świecie cierpi na chorobę Alzheimera blisko 44 miliony ludzi. W Polsce na tę chorobę choruje około ok. 350 tys. osób.
Jak wiadomo około 12 % społeczeństwa zapada na demencję przed ukończeniem 65. roku życia. Ryzyko zachorowania wzrasta z wiekiem do 50 % wśród osób, które osiągnęły 100 lat. Stowarzyszenie Alzheimera szacuje, że w związku ze starzeniem się i wydłużeniem średniej życia amerykańskiego społeczeństwa liczba osób cierpiących na chorobę Alzheimera może do roku 2050 wzrosnąć do 16 milionów.
Zachorowania po 65. roku życia określa się jako chorobę Alzheimera o późnym początku i nie jest ona uważana za chorobę dziedziczną. Natomiast postać o wczesnym początku – rozpoczynająca się przez 65. rokiem życia – stanowi od 5% do 10 % wszystkich przypadków i jak wiadomo związana jest z mutacją w genach.
Powiązania genetyczne
Chorobę Alzheimera wywołać mogą różne czynniki. Wprawdzie wiele z nich nie zostało jeszcze dobrze poznanych, lecz wiadomo, że niektóre są genetyczne uwarunkowane. Z bardzo rzadkimi formami wcześnie występującej rodzinnej choroby Alzheimera (EOFAD, zwana również chorobą Alzheimera typu 3 lub AD3) powiązane są trzy geny (PSEN1, PSEN2 i APP).
Mutacja jednego z tych genów może prowadzić do produkcji nieprawidłowego białka, co przyczynia się do powstawania blaszek starczych powodujących postępującą demencję. Wystarczy tylko jedna zmiana kopi któregokolwiek z genów, aby wywołać chorobę, co oznacza, że istnieje 50-procentowe prawdopodobieństwo odziedziczenia tej mutacji po rodzicu. W sytuacji, gdy w rodzinie danej osoby choroba Alzheimera występowała przed 65. rokiem życia w kilku pokoleniach, zalecane są badania genetyczne.
Nie wykryto genów wywołujących chorobę Alzheimera o późnym początku. Jednak znaleziono kilka wariantów genów związanych z tym schorzeniem; co prawda nie decydują one o późnym wystąpieniu choroby, ale zwiększają jej ryzyko w porównaniu do osób, u których tych zmian nie stwierdzono. Geny „podatności” mogą wyjaśnić dlaczego u osób, których członkowie rodziny są dotknięci chorobą Alzheimera ryzyko wystąpienia późnej postaci choroby wzrasta.
Najlepiej rozpoznanym genem podatności jest gen ApoE. Kieruje on procesem wytwarzania apolipoproteiny E – białka, które jest częścią ogółu lipoprotein w organizmie (takich jak cholesterol VLDL) oraz bierze udział w transporcie lipidów i usuwaniu z organizmu tłuszczy pochodzących z pokarmów. Normalnie gen ApoE występuje w trzech formach: e2, e3 i e4. Każdy człowiek posiada dwie kopie genu ApoE, w kombinacji tych trzech form. Najbardziej powszechny jest allel e3, który występuje u 60 % populacji. Stwierdzono, że allel e4 jest czynnikiem ryzyka wystąpienia choroby Alzheimera (zwłaszcza w zestawieniu przypadków rodzinnych i sporadycznych).
U większości osób z zespołem Downa (risomia chromosomu 21) w pewnym momencie dochodzi do wystąpienia zmian psychicznych związanych z chorobą Alzheimera zwykle, gdy osiągną 40 lub 50 lat. Badana wykazały, że zmiany stwierdzone w mózgu dorosłych z zespołem Downa są podobne do tych stwierdzanych w chorobie Alzheimera. Dodatkowa kopia chromosomu 21 powoduje wzmożoną produkcję białka, które gromadząc się tworzy blaszki starcze podobne do zaobserwowanych w chorobie Alzheimera. Uważa się, że u krewnych osób z zespołem Downa nie występuje zwiększone ryzyko wystąpienia choroby Alzheimera, ponieważ nie mają dodatkowej kopii chromosomu 21.
Ryzyko wystąpienia AD zależy również od pochodzenia etnicznego. U Afroamerykanów jest ono nawet czterokrotnie a u Latynosów dwukrotnie wyższe niż u osób rasy białej.
Do innych czynników ryzyka związanych z wystąpieniem AD należą: otyłość, zaburzenia metaboliczne i insulinooporność, cukrzyca, wysokie ciśnienie tętnicze, dyslipidemia, cukrzyca, nadciśnienie tętnicze oraz wysoki poziom markerów procesu zapalnego, np.: białko C-reaktywne (CRP).
W 2011 roku trzy robocze grupy specjalistów pod kierownictwem Stowarzyszenia Alzheimera oraz Krajowego Instytutu ds. Starzenia się (NIA) z Krajowego Instytutu Zdrowia (NIH) opublikowały nowe kryteria i wytyczne dotyczące choroby Alzheimera.
Rozszerzają one definicję choroby Alzheimera na trzy etapy:
Według Stowarzyszenia Alzheimera istnieje 10 wczesnych objawów choroby. Niektóre problemy z pamięcią są normalnym elementem procesu starzenia, jednak objawy związane z chorobą Alzheimera są zazwyczaj poważniejsze i występują częściej. Są to między innymi:
Nie istnieją badania laboratoryjne, na podstawę których można byłoby rozpoznać chorobę Alzheimera w czasie trwania życia pacjenta. Obecnie jedynym badaniem pozwalającym na definitywne rozpoznanie AD jest badanie wycinka mózgu pacjenta po jego śmierci. Patologowie szukają charakterystycznych dla tej choroby blaszek starczych i zmian neurowłókienkowych. Z uwagi na to, że zmiany te występują również w prawidłowym procesie starzenia się organizmu, wycinek należy porównać z próbką kontrolną (prawidłową tkanką mózgową bez zmian będących wynikiem AD) pobraną od osoby w tym samym wieku.
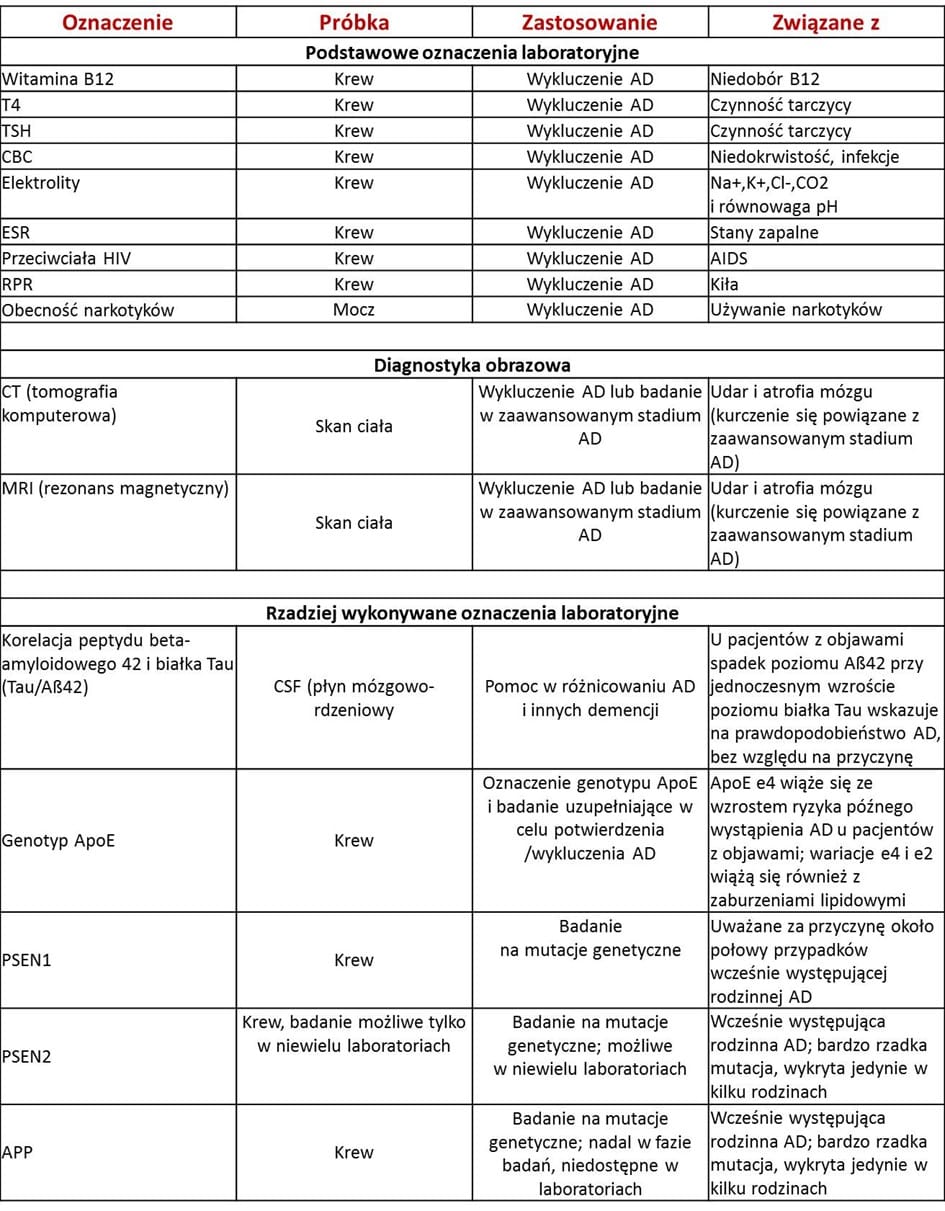
Jednak lekarze mogą obecnie postawić niemalże pewne rozpoznanie choroby Alzheimera dzięki różnorodnym badaniom pozwalającym wykluczyć inne przyczyny demencji. Lekarz analizuje historię zachorowań w rodzinie (najlepiej na kilku pokoleniach), przeprowadza badanie przedmiotowe, ustala wiek, w którym choroba wystąpiła oraz przeprowadza badania neuropsychologiczne w celu oceny stanu pamięci, umiejętności językowych i innych funkcji poznawczych pacjenta. Można również wykonać tradycyjne oznaczenia laboratoryjne pozwalające na wykluczenie niedoborów oraz innych chorób i stanów klinicznych mogących mieć wpływ na pamięć pacjenta. Kolejny krok to ustalenie czy pacjent nie spożywał nadmiernej ilości leków oraz wykonanie badań obrazowych jak na przykład tomografia komputerowa (CT) oraz rezonans magnetyczny (MRI) w celu poszukiwania śladów urazów, guzów oraz udarów mogących powodować demencję oraz wykrycia atrofii mózgu (kurczenie się, zazwyczaj występujące w późniejszych stadiach choroby Alzheimera). W przypadku podejrzenia AD można również wykonać mniej popularne badania (patrz tabela) w celu różnicowania pomiędzy AD a innymi formami demencji oraz sprawdzenia czynników ryzyka genetycznego.
Oznaczenia wspomagające kategoryzację demencji
Nieznane są jeszcze sposoby zapobiegania i leczenia choroby Alzheimera. Pacjenci mogą przeżyć od roku do 25 lat z tą chorobą – średnia wynosi 8-10 lat. Leczenie polega a próbach spowalniania postępu choroby, łagodzeniu objawów, panowaniu nad zmianami behawioralnymi i wsparciu oraz edukowaniu opiekunów i pacjenta. We wczesnych stadiach choroby pacjenci mogą prowadzić prawie normalne życie, korzystając z niewielkiej pomocy jak na przykład wspomaganie pamięci i uporządkowanie otoczenia. W tym okresie pacjent może czynić plany i brać udział w decyzjach odnośnie do opieki w dalszych stadiach choroby.
Wczesne wykrycie AD pozwala niektórym pacjentom na skorzystanie z inhibitorów cholinesterazy, takich jak tauryna, donepezil i rywastygmina, które pozwalają zachować sprawność intelektualną poprzez zachowanie działania acetylocholiny (neuroprzekaźnika w mózgu pozwalającego na komunikację pomiędzy nerwami a poszczególnymi częściami mózgu). Jeżeli jest to możliwe, dokonuje się również oceny innych przyjmowanych przez pacjenta leków i odstawia się te, które mogą powodować pogłębienie się objawów splątania, takie jak antydepresanty centralnego układu nerwowego, leki antyhistaminowe, środki nasenne i przeciwbólowe.
Wraz z postępem choroby można wprowadzić niewielkie dawki antydepresantów i innych leków oraz odpowiednio zaadaptować bezpośrednie otoczenie chorego (urządzenie domu w bezpieczniejszy i bardziej znajomy sposób) w celu złagodzenia problemów behawioralnych i osobowościowych takich jak depresja, pobudzenie, paranoja i agresja. Pozwala to na zapewnienie pacjentowi większego komfortu.
Wprawdzie obecnie prowadzone badania nad leczniczym działaniem pewnych substancji dobrze rokują, lecz nie można jeszcze zalecić konkretnych leków, ponieważ każdy z nich obarczony jest pewnym ryzykiem oraz skutkami ubocznymi. W celu ustalenia ich skuteczności oraz długofalowego bezpieczeństwa niezbędne są dalsze badania.
Testy:
Genotypowanie ApoE, cHoroba Alezheimera
PSEN1
Linki do stron obcojęzycznych:
National Institute of Neurological Disorders and Stroke: Alzheimer’s Disease In…
Gene Reviews: Alzheimer Disease Overview
Alzheimer Research Forum
NIH: Alzheimer’s Disease & Related Dementias
Bright Focus Foundation: About Alzheimer’s
Alzheimer Society of Canada
Alzheimer’s Association: Alzheimer’s Disease Facts and Figures